近日
北京市自然科學基金
資助的重點研究專題項目
“超高分辨冷凍電子顯微鏡
成像方法研究與應用”
在該項目支持下,北京大學毛有東教授團隊于2022年4月27日在國際學術期刊Nature雜志在線發(fā)表了題為“USP14-regulated allostery of the human proteasome by time-resolved cryo-EM”的研究論文,闡明了原子水平人源蛋白酶體動力學調控和構象重編程機制,并在國際上展示了人工智能四維重建技術用于大幅提升時間分辨冷凍電鏡分析精度。

蛋白酶體功能紊亂與人體多種疾病相關,如癌癥、神經(jīng)退行性疾病和免疫疾病等。蛋白酶體是美國FDA批準的多種治療癌癥的上市小分子藥物的直接靶標。
在正常細胞中,蛋白酶體的功能受到多個水平的嚴格調控。去泛素化酶USP14是主要的蛋白酶體調控分子,被認為是一個潛力大的治療癌癥和神經(jīng)退行性疾病的重要靶標,其小分子抑制劑曾進入過美國一期臨床研究,但圍繞USP14功能機制的一系列懸而未決的關鍵問題限制了其靶向藥物分子的開發(fā)和臨床應用。USP14通過結合26S而被激活,然后以毫秒的時間尺度剪切底物上的泛素鏈。它是如何被蛋白酶體激活并調控蛋白酶體功能的,一直是研究機構和生物制藥領域期待解決的關鍵科學問題。生命分子機器通過復雜的非平衡動力學過程和結構變化來實現(xiàn)其特殊功能,這一過程進而受到各種復雜分子間相互作用的精準調控。如何在原子水平直接觀察天然態(tài)超大分子機器的功能態(tài)動力學過程,給現(xiàn)有的原子結構動態(tài)分析技術提出了挑戰(zhàn)。毛有東教授實驗室長期致力于發(fā)展基于冷凍電鏡的動力學重建方法,圍繞蛋白酶體、炎癥小體等具有重大臨床應用前景的靶點系統(tǒng)的結構功能、動力學機制和靶向調控分子設計深入開展交叉研究。課題組前期的系列工作揭示了蛋白酶體的原子架構、組裝原理和降解泛素化底物的動力學基本規(guī)律。
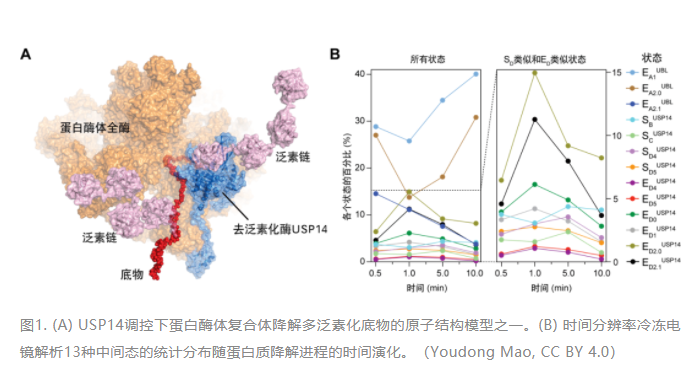
本研究課題進行之初,首先要克服的問題就是“時間分辨”。蛋白酶體降解底物的過程是很快的,時間尺度在毫秒至秒之間。正常條件下,想要通過冷凍電鏡技術捕獲此過程的中間態(tài)結構,是非常困難的。所以,課題組首先要讓這個過程慢下來。通過大量的條件摸索,重建反應動力學體系和優(yōu)化反應條件,包括優(yōu)化緩沖體系、反應溫度等條件,課題組優(yōu)化出較為可行的實驗方案,從而使得時間分辨冷凍電鏡技術應用成為可能,獲得了含時的45,193張USP14-26S復合體降解泛素底物過程中的冷凍電鏡透射圖樣,挑取了3,556,806個USP14-26S-泛素底物復合體的顆粒圖像。
接下來面臨的極端挑戰(zhàn)就是“三維分類”,冷凍電鏡捕獲的復合體圖像需要經(jīng)過一系列的分類,將它們歸為不同的構象類別,才能呈現(xiàn)出蛋白反應的動態(tài)過程。USP14結合到26S蛋白酶體后,使得降解底物的動力學過程更加復雜,想要在如此多的異構復合體顆粒圖像中,鑒別出降解過程的各個時態(tài)的高分辨率非平衡構象,傳統(tǒng)的三維分類方法是無法實現(xiàn)的。低精度的三維分類將導致低分辯的三維重建,從而無法獲取原子水平的動力學信息,無法對含時的數(shù)據(jù)賦予自洽的動態(tài)變化的物理意義。課題組結合經(jīng)過數(shù)年自主開發(fā)的新型深度學習高精度三維分類和四維重建方法,捕獲了USP14-26S復合體降解多泛素化底物過程的13種不同功能中間狀態(tài)的高分辨率(3.0~3.6埃)非平衡構象,通過時間分辨冷凍電鏡分析,重建了受控蛋白酶體的完整動力學工作周期,并結合分子生物學功能和基因突變研究,闡明了USP14和26S相互調控活性的原子結構基礎和非平衡動力學機制。研究發(fā)現(xiàn)USP14的活化同時依賴于泛素識別和蛋白酶體RPT1亞基的結合。出人意料的是,USP14通過別構效應,誘導蛋白酶體同時沿著兩條并行狀態(tài)轉變路徑發(fā)生構象變化;課題組成功捕獲到了底物降解中間狀態(tài)向底物抑制中間狀態(tài)的瞬時轉化。在底物降解途徑中,USP14活化變構地重編程AAA-ATP酶馬達的構象景觀(Conformational landscape)和統(tǒng)計分布,并刺激20S底物通道的打開,從而觀察到底物持續(xù)轉運過程的ATPase六聚馬達非對稱ATP水解和近乎完整的全周循環(huán)周期。USP14-ATPase的動態(tài)相互作用,使得ATPase馬達底物識別與26S自身的去泛素化酶RPN11催化發(fā)生去耦合效應,并在26S的泛素識別、底物的起始易位和泛素鏈回收過程中引入三個調控檢查點(動力學分岔點)。這些發(fā)現(xiàn)為USP14調節(jié)26S的完整功能周期提供了新的高分辨見解,并為USP14靶向藥物治療發(fā)現(xiàn)奠定了極為重要的機制基礎。
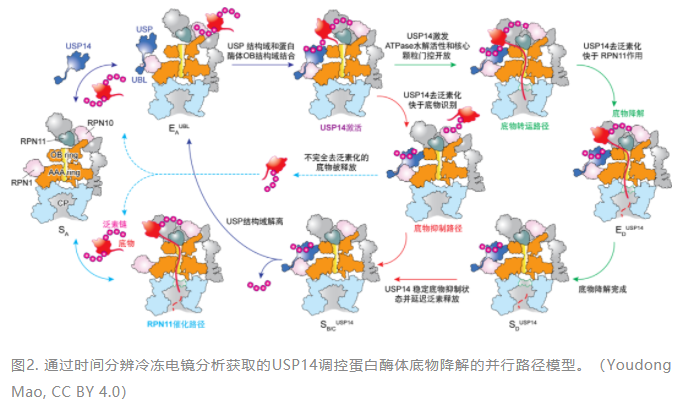
圖2. 通過時間分辨冷凍電鏡分析獲取的USP14調控蛋白酶體底物降解的并行路徑模型。(Youdong Mao, CC BY 4.0)
這是將人工智能四維重建技術用于提升時間分辨冷凍電鏡分析精度,針對重大疾病靶蛋白復合體,實現(xiàn)原子水平功能動力學觀測的國際原創(chuàng)成果,展示了一類新型的蛋白質復合動力學研究范式。Nature同期在線發(fā)表了專欄推介文章,評價該成果是一項重大研究,解決了原子水平USP14(泛素特異性肽酶14)活化和其調控蛋白酶體功能的機制問題。
相關論文鏈接:
https://doi.org/10.1038/s41586-022-04671-8
轉載:江西立康公眾號 鏈接:https://mp.weixin.qq.com/s/QUyfgibh3gADVPyZQsaPSg



